■ 研究概要(日本語)
グローカルヘルスケア分野では、がんや臓器の機能不全時などに認められる「疼痛・炎症」の概日変動のメカニズム解明を通じて、新しい治療標的分子の探索と製剤技術の開発を行っています。
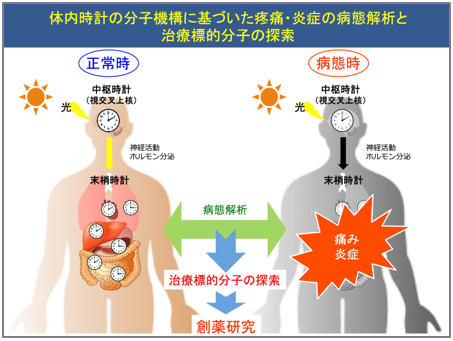
1. 体内時計の分子機構に基づいた疼痛・炎症の病態解析と治療標的分子の探索
疾患の症状や発症には概日性(24時間周期性)の変動を示すものがあることが知られていいます。例えば高血圧、狭心症、端息などの疾患は、それらの症状がー日の中の特定の時間帯に悪化します。この様な病態に認められる概日リズムは、体内時計を構成する「時計遺伝子」の働きによって引き起こされることが明らかになりつつあり、臨床応用への試みが期待されています。
ヘルペスウイルス感染、糖尿病による末梢神経障害、がん細胞の神経への浸潤などによって引き起こされる「痛み」や「炎症」も一日の中の特定の時間帯に増悪することが知られていますが、そのメカニズムは明らかになっていません。当研究室では、体内時計によって「痛み」や「炎症」に概日変動が生じる仕組みを解明するアプローチから新しい治療標的分子の探索を行っています。また、「疼痛・炎症」を特定に時間帯に悪化させる分子を標的した医薬品開発に向け、化合物ライブラリーなどを活用した創薬研究も実施しています。
2. 薬物動態および薬効制御因子の概日リズム制御機構のアニマルスケールアップ
一般に、薬の効果は作用部位における「薬物に対する感受性」と、その部位における「薬物の濃度」によって規定されます。さらに、病巣部位への薬の移行は吸収・分布・代謝・排泄の各過程によって変動します。薬物の体内での挙動(薬物動態)は服用する時刻によっても変化し、病巣部位への薬の移行量にも影響を及ぼします。当研究室では、薬物動態の制御に関わる代謝酵素やトランスポーターの概日リズム機構を解析し、夜行性の実験動物と昼行性のヒトとの差異について研究を行っています。また、得られた結果と数理モデルによる解析から、夜行性の実験動物のデータを基に、ヒトにおける至適投薬タイミングを設定する方法論の構築を目指しています。
3. 疾患・病態の概日性変動を考慮した製剤技術の開発
がんによる「痛み」や臓器不全による「炎症」は慢性的に持続するため、作用時間の短い薬では長期間に及ぶ繰返し投与が必要になります。そのため、1回の投与で薬効が持続でき、副作用も少ない安全な医薬品の開発が求められています。当研究室では、この間題点を解決するため、薬物の物性に適した素材(ポリマーなど)を選択し、体内での薬物の濃度を長期にわたって持続できるような製剤開発を行っています。また、体内時計の分子機構に基づき、特定の時刻に病巣へ薬物を送達できる技術開発を目指しています
■ Research
A variety of pathological conditions exhibit profound day-night changes in the symptom intensity with a large portion exacerbating and occurrence of grave events. Recent developments in our understanding of circadian biology and the availability of tools to characterize the molecular clock indicate that the choosing appropriate dosing time have consequences for the efficacy and safety of new and existing therapeutic drugs. Progression of this research field also suggests that many pathological conditions are under the control of the circadian clock. These notions reveal opportunities for new therapeutic strategies. Now novel therapeutic approaches are facilitated by development of chemical probes and synthetic ligands targeted to an increasing number of the key proteins that causing circadian exacerbation of pathological events.
■代表論文
■連絡先
